Historia entrelazada de nailon y poliéster
Descubra en este artículo la relación entre el nailon y el poliéster en la industria de los materiales poliméricos, además del papel clave de la química aromática en el avance de los poliésteres y su impacto en la industria textil.
La misma ola de innovación que produjo el desarrollo del nailon también creó los poliésteres sintéticos. Julian Hill, miembro del equipo de DuPont dirigido por Wallace Carothers, sintetizó por primera vez poliésteres que podían hilarse en fibras.
Esto ocurrió antes del desarrollo del nailon; sin embargo, una vez que las propiedades del nailon se hicieron evidentes, el trabajo sobre los poliésteres se dejó de lado. La historia del nailon y los poliésteres se ha entrelazado desde entonces, y para apreciar la razón de esto es útil saber un poco de química.
Tanto los poliésteres como los primeros náilones son polímeros de condensación. Las reacciones que se utilizan para crear estos materiales comenzaron a ser analizadas por Carothers ya en 1926, cuando todavía estaba vinculado al mundo académico. Una vez que tuvo los recursos de los laboratorios de DuPont a su disposición, no tardó en pasar de la teoría a la práctica.
La química detrás de los polímeros de condensación
Los polímeros de condensación se crean al hacer reaccionar ciertos tipos de productos químicos que tienen grupos funcionales en ambos extremos de la molécula, de modo que la reacción puede extender el producto resultante en ambas direcciones, produciendo así una cadena larga.
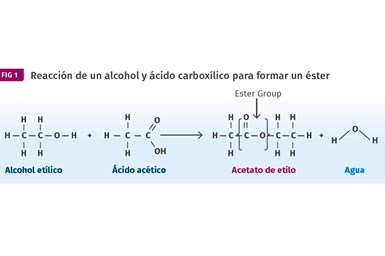
Los ésteres se producen por la reacción de alcoholes con ácidos carboxílicos. Como se muestra aquí, el alcohol etílico se combina con ácido acético para producir el éster, acetato de etilo.
Crédito: Mike Sepe.
Los ésteres se obtienen por la reacción de alcoholes con ácidos carboxílicos. Un ejemplo se muestra en la figura 1, donde el alcohol etílico se combina con ácido acético para producir el éster, acetato de etilo (en química orgánica, si el nombre del compuesto termina en “-ato”, casi con seguridad es un éster).
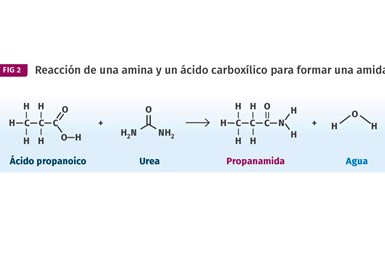
El éster contiene el grupo distintivo resaltado en la imagen. Las amidas se hacen de manera similar, excepto que en lugar de un alcohol usamos una amina. Esto se muestra en la figura 2. En esta reacción, el ácido propanoico se combina con la urea amina para producir propanamida.
Las amidas se fabrican de manera similar a los ésteres, excepto que en lugar de un alcohol usamos un compuesto que contiene nitrógeno, conocido como amina.
Crédito: Mike Sepe.
En ambos casos, uno o ambos reactivos tienen un grupo reactivo en un solo extremo de la molécula, por lo que, una vez producida la reacción, el proceso termina. Sin embargo, Carothers y su equipo descubrieron que, si usaban reactivos con grupos funcionales en ambos extremos de la molécula, la reacción podría extenderse para crear una macromolécula de cadena larga, un polímero.
El poliéster, que en realidad se había sintetizado antes mediante el mismo tipo de reacción, quedó relegado a un segundo plano mientras toda la atención se centraba en el nailon.
La importancia de los enlaces de hidrógeno en las propiedades del nailon
Para entender la razón de esto, necesitamos apreciar la química del éster y los grupos amida. El grupo amida consiste en un enlace nitrógeno-carbono dentro de la columna central del polímero. Unido al carbono por un doble enlace hay un átomo de oxígeno, mientras que un átomo de hidrógeno está unido al nitrógeno.
Esto establece una situación muy fortuita. Ambos segmentos del grupo amida se comportan como pequeños imanes con un polo positivo y negativo bien definido. En el caso del enlace C = O, el oxígeno está cargado negativamente, mientras que en el enlace N-H el hidrógeno está cargado positivamente.
Cuando los segmentos vecinos de las cadenas de polímeros se alinean, las fuerzas de atracción entre el oxígeno cargado negativamente y el hidrógeno cargado positivamente son muy fuertes y dan como resultado propiedades mecánicas superiores y un punto de fusión muy alto.
El punto de fusión de 260 °C (500 °F), así como la muy alta resistencia y módulo del material llamaron la atención de los investigadores de DuPont. La presencia del hidrógeno unido al nitrógeno es clave en este caso.
El hidrógeno, el elemento más simple de nuestro universo, consiste en un núcleo que contiene un solo protón cargado positivamente alrededor del cual orbita un solo electrón cargado negativamente. Cuando cualquier átomo entra en una reacción química, lo hace compartiendo al menos un electrón con un compañero.
En el caso del hidrógeno, compartir este electrón deja el núcleo positivo desprotegido. Si el átomo asociado es capaz de alejar el electrón de hidrógeno lo suficiente de su núcleo, el núcleo positivo puede participar en una fuerza de atracción muy fuerte conocida como enlace de hidrógeno.
Solo tres elementos son capaces de alejar el electrón de hidrógeno lo suficientemente de su núcleo para crear tal enlace de hidrógeno, y el nitrógeno es uno de ellos. Cuando estas fuertes cargas positivas se alinean con los átomos de oxígeno cargados negativamente, las fuerzas que unen estos segmentos se vuelven muy fuertes y el resultado se ve en las excelentes propiedades del nailon.
Es importante tener en cuenta que la estructura del polímero de nailon entre los grupos amida consta de solo una cadena de carbono con átomos de hidrógeno unidos a los lados de la cadena. Esto se parece a la estructura química del polietileno, una geometría molecular simple que se conoce en química como una estructura alifática.
Las estructuras alifáticas no suelen dar lugar a propiedades térmicas y mecánicas muy impresionantes. Pero funciona en poliamidas porque la combinación de las fuertes atracciones que proporcionan los enlaces de hidrógeno, junto con la simetría del espaciado del grupo amida, entrega propiedades que están mucho más allá de lo que normalmente se esperaría.
Entonces, ¿por qué los poliésteres se dejaron en un segundo plano en favor de la química del nailon? Si volvemos a la estructura de la figura 1, podemos ver que el grupo éster, aunque similar al del grupo amida, no tiene posibilidad de formar enlaces de hidrógeno.
En lugar del grupo N-H tenemos solo un átomo de oxígeno. La ausencia de enlaces de hidrógeno dio como resultado poliésteres alifáticos con puntos de fusión mucho más bajos y una resistencia mucho menor.
Un poliéster alifático con un peso molecular promedio comparable al del nailon 66 tendría un punto de fusión de solo 80 °C (176 °F) y también mostraría una tendencia significativa a sufrir hidrólisis. Estas propiedades no cumplían las expectativas de los investigadores de DuPont, que estaban centrados principalmente en fibras para telas y ropa.
Por tanto, aunque la creación del poliéster y su formación en fibras en el laboratorio ocurrieron tres años antes que el nailon, todo el énfasis se hizo en el desarrollo del nailon y el poliéster quedó relegado.
El resurgimiento de los poliésteres: la introducción de la química aromática
En la última parte de la década de 1930, dos investigadores británicos, John Rex Whinfield y James Tennant Dickson comenzaron a revisar el trabajo que el equipo de Carothers en DuPont había realizado con poliésteres.
Descubrieron que el equipo de DuPont no había seguido la vía de mejorar el perfil de propiedades del poliéster mediante el uso de una química que reemplazara las estructuras alifáticas originales con un tipo de química conocida como aromática.
En química, el término aromático tiene un significado muy particular: se refiere a una estructura química en forma de anillo que generalmente involucra seis carbonos y está ejemplificada por sustancias como el benceno y el xileno.
Los anillos aromáticos son una parte indispensable de la química moderna de polímeros, pero en la década de 1930 su uso se limitaba a polímeros termoestables como el fenólico. Estos anillos, planos y muy rígidos imparten, por lo tanto, mejoras significativas en el rendimiento térmico y mecánico cuando se incorporan a compuestos orgánicos y polímeros.
En 1939, Whinfield y Dickson utilizaron un ácido carboxílico aromático, el ácido tereftálico, en combinación con etilenglicol, para producir el primer poliéster comercialmente viable, tereftalato de polietileno (PET).
En trabajo con dos inventores británicos, W. K. Birtwhistle y C. G. Ritchie, patentaron el poliéster PET y comercializaron una fibra basada en el material que fue presentada por Imperial Chemical Industries (ICI), en 1941, como Terylene.
Este desarrollo inició la larga historia de los poliésteres sobre los que hablaremos en nuestra próxima entrega.
CONTENIDO RELACIONADO
-
Diagnóstico ambiental empresarial: ¿por qué es clave?"
Aprenda cómo el diagnóstico ambiental puede impulsar la certificación de industria limpia y mejorar la competitividad de las empresas. Luigi Pontones, socio fundador del bufete de abogados Pontones & Ledesma que asesora a Braskem-Idesa en el Proyecto Polietileno XXI, habla sobre la importancia de un diagnóstico ambiental en las empresas.
-
Cristalinidad en polímeros: aplicaciones en el procesamiento de PET
Aprenda sobre los factores y procesos que afectan la cristalinidad en polímeros y cómo optimizar la producción y calidad de productos a base de PET.
-
¿Qué es el poliestireno (PS)? tipos y aplicaciones desglosadas
Conozca los diferentes tipos de poliestireno (GPPS, HIPS, EPS) y sus variadas aplicaciones en sectores como la salud, construcción y electrónica.



.jpg;width=70;height=70;mode=crop)